Det tredje formål med serologiske tests er at påvise antigener, fx polysakkarider, lipopolysakkarider eller proteiner, fra den inficerende mikroorganisme, der udskilles i urinen under lungebetændelse (Streptococcus pneumoniae og Legionella pneumophila) eller som findes på bakterierne i svælgsekret under halsbetændelse.
Der kan påvises et antigen (gruppe A-antigenet) i sekretet fra Streptococcus pyogenes gruppe A på fem minutter ved en serologisk test. På den måde kan testen udføres mens patienten venter hos lægen, så penicillinbehandlingen straks kan startes.
Ved influenza A-infektion kan man på lignende måde påvise influenza nukleoprotein i næse- og svælgsekret på 15 minutter, så behandling og isolation straks kan startes. Ved disse eksempler er det også kaninserum fra vaccinerede kaniner, der anvendes til at påvise mikroorganismen i patientens sekret eller urin.
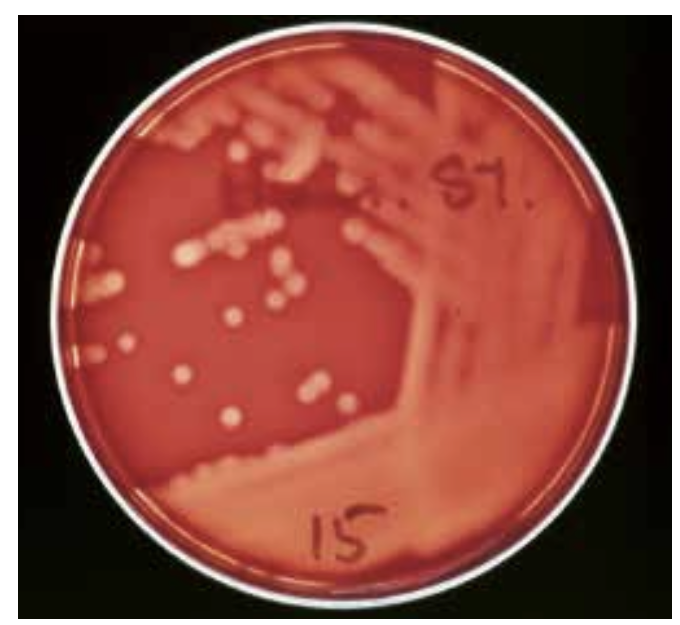
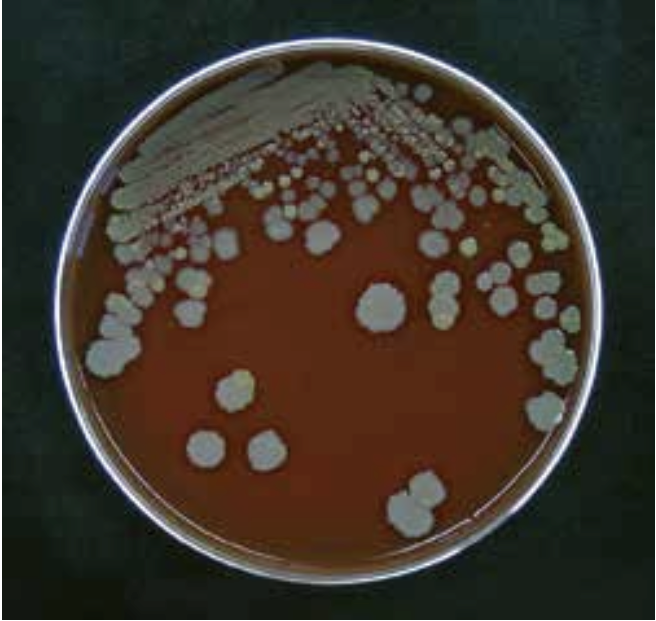
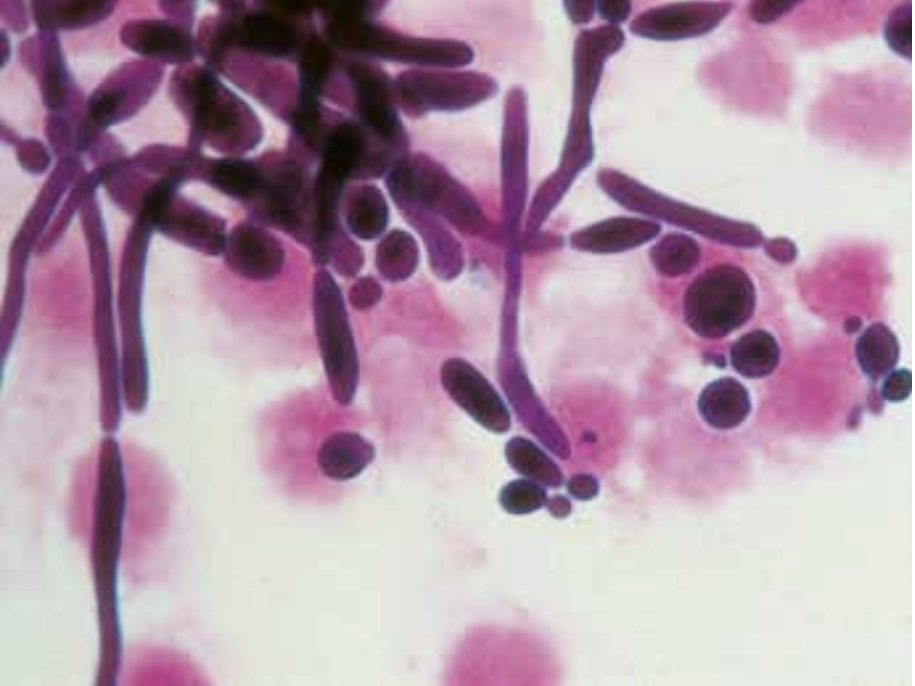
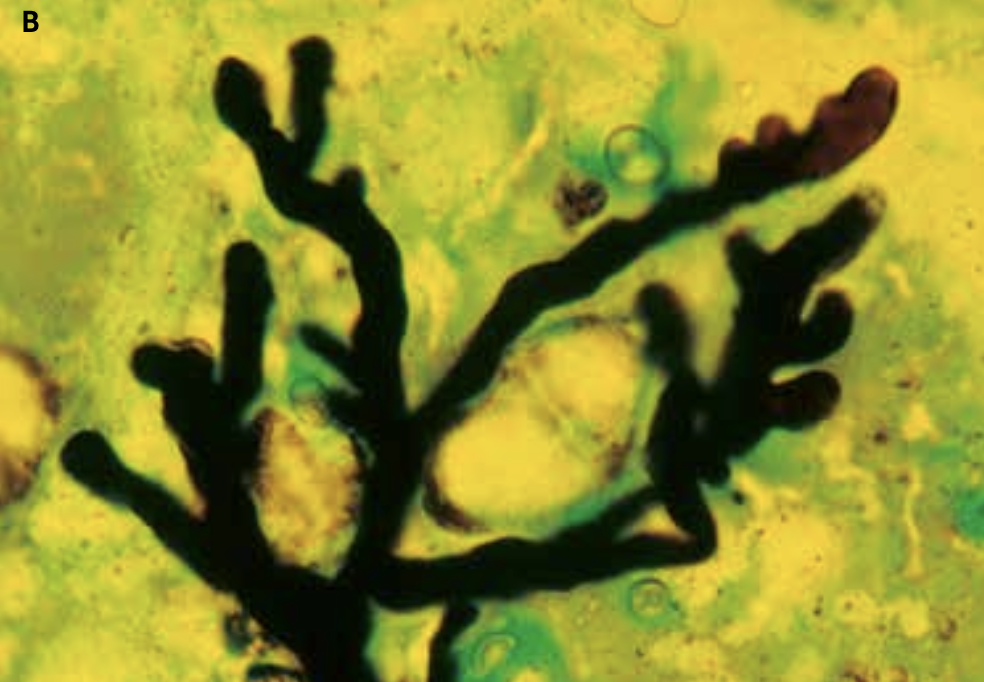
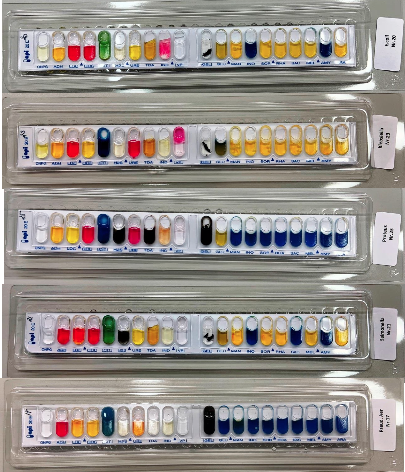
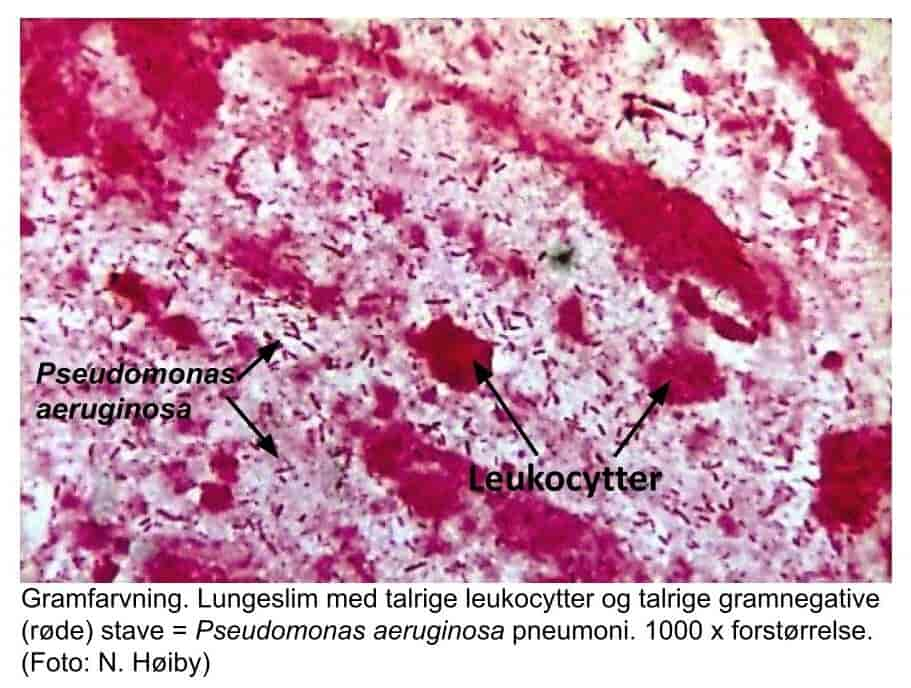
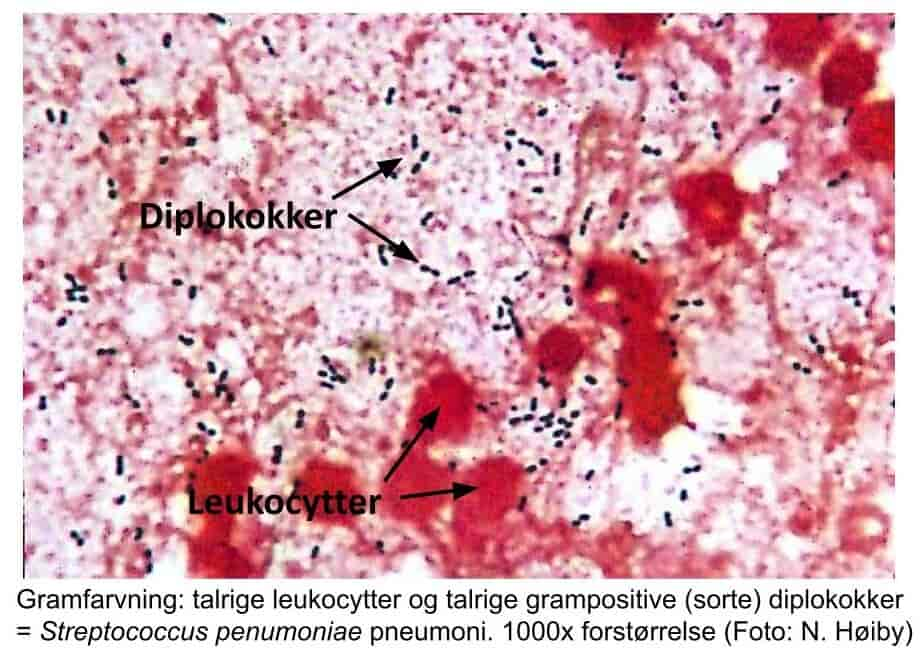
Behovet for hurtigdiagnostik med direkte påvisning af bakterier og svampe i klinisk prøvemateriale er vigtigt. Den klassiske metode, som udføres i alle laboratorier, er mikroskopi af gramfarvede præparater enten direkte på prøvematerialet fra patienten (figur 11, 12, 17, 18), eller af fremvoksede bakterier eller svampe i fx en bloddyrkning.
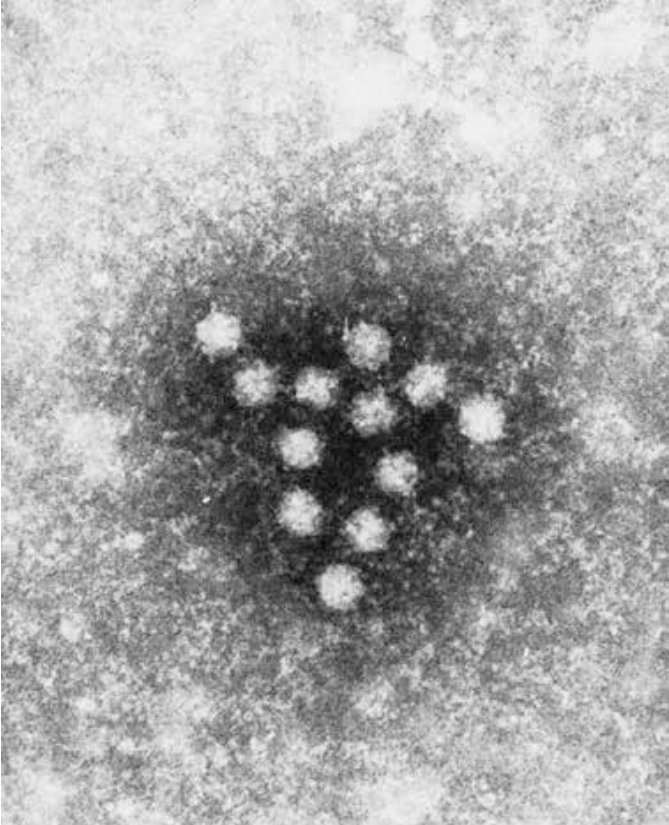
Bakterieelementer, der egner sig til andre måder for direkte påvisning, er proteiner, polysakkarider og lipopolysakkarider. De er alle antigener, så de kan påvises med antistoffer, hvis de fx udskilles i urinen eller findes i spyt og svælgsekret. Derudover nukleinsyrer (DNA eller RNA), som påvises med PCR reaktion. De enkelte virus kan ikke ses i prøvematerialet med almindeligt lysmikroskopi, men kræver elektronmikroskopi (figur 9) med meget højere forstørrelse, fordi de er så små.
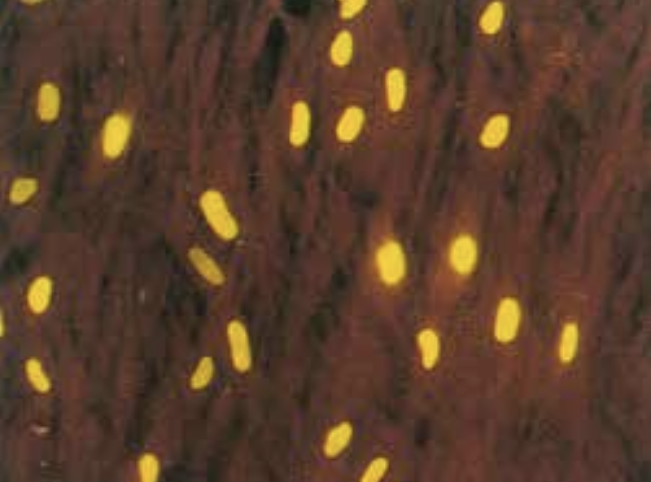
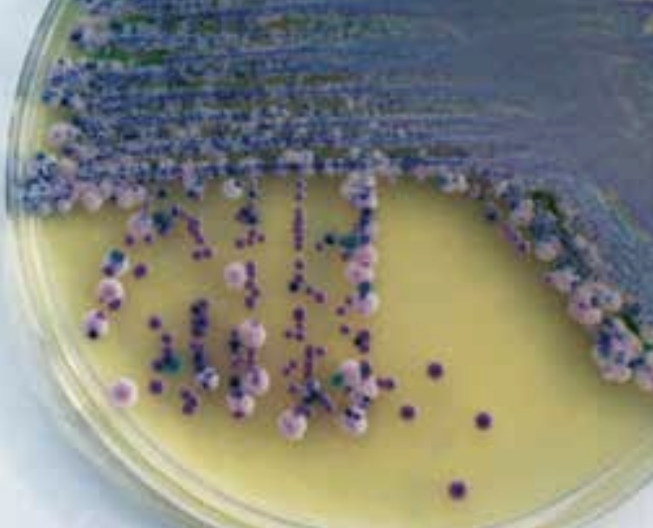
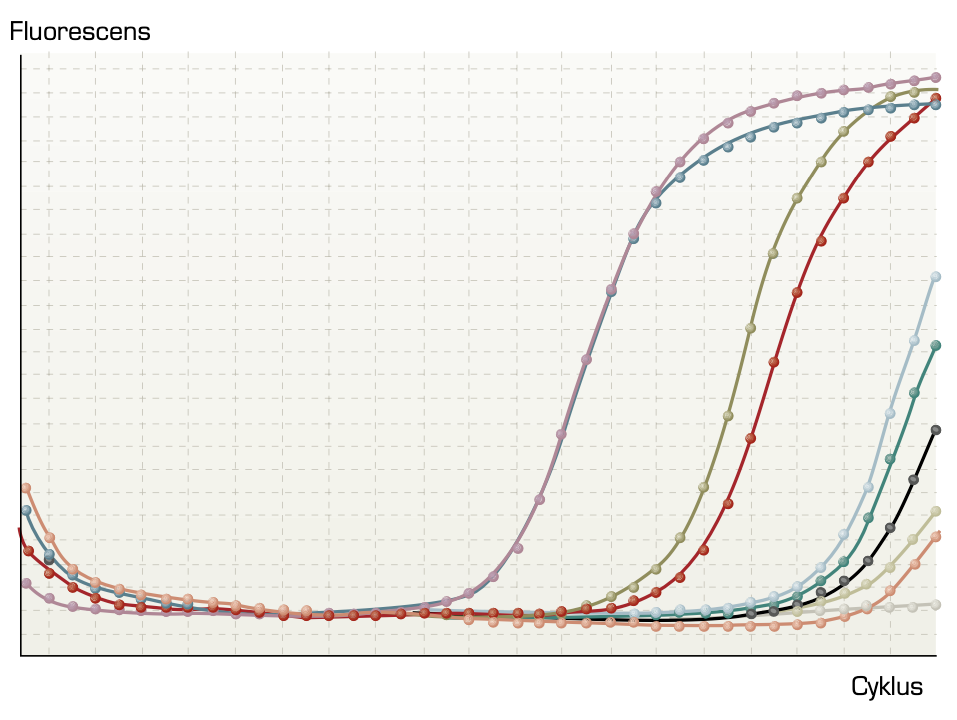
Når man har velegnede antigener og antistoffer, kan protein- og polysakkaridpåvisning udføres med immunologiske metoder. De polysakkarider, der hyppigst undersøges for, er fra cellevæggen i Streptococcus pyogenes gruppe A (figur 1) og kapslen på pneumokokker og på gærsvampen Cryptococcus neoformans. Bakteriespecifikke, svampespecifikke og virusspecifikke nukleinsyrer kan påvises ved brug af polymerasekædereaktion (PCR) (figur 10).






Kommentarer
Kommentarer til artiklen bliver synlige for alle. Undlad at skrive følsomme oplysninger, for eksempel sundhedsoplysninger. Fagansvarlig eller redaktør svarer, når de kan.
Du skal være logget ind for at kommentere.