Ved brug af agardiffusionsmetoden udsås bakterien på fast substrat i agarskåle, og der pålægges derefter antibiotika som depoter i tabletter eller papirlapper med bestemte koncentrationer af de antibiotika, der skal undersøges. Pladen placeres i en inkubator til næste dag, hvor aflæsningen af resultatet foretages.
Hvert antibiotikum vil diffundere fra depotet og ud i næringsmediet, samtidig med at bakterierne, som er udsået på mediet, begynder at vokse og danne tætliggende kolonier omkring depotet. Derved opstår der en koncentrationsgradient fra depotet og ud i agaren. Det vil sige, at jo længere væk fra depotet man kommer, jo lavere er koncentrationen af antibiotika i mediet, men koncentrationen skifter under diffusionen (figur 1).
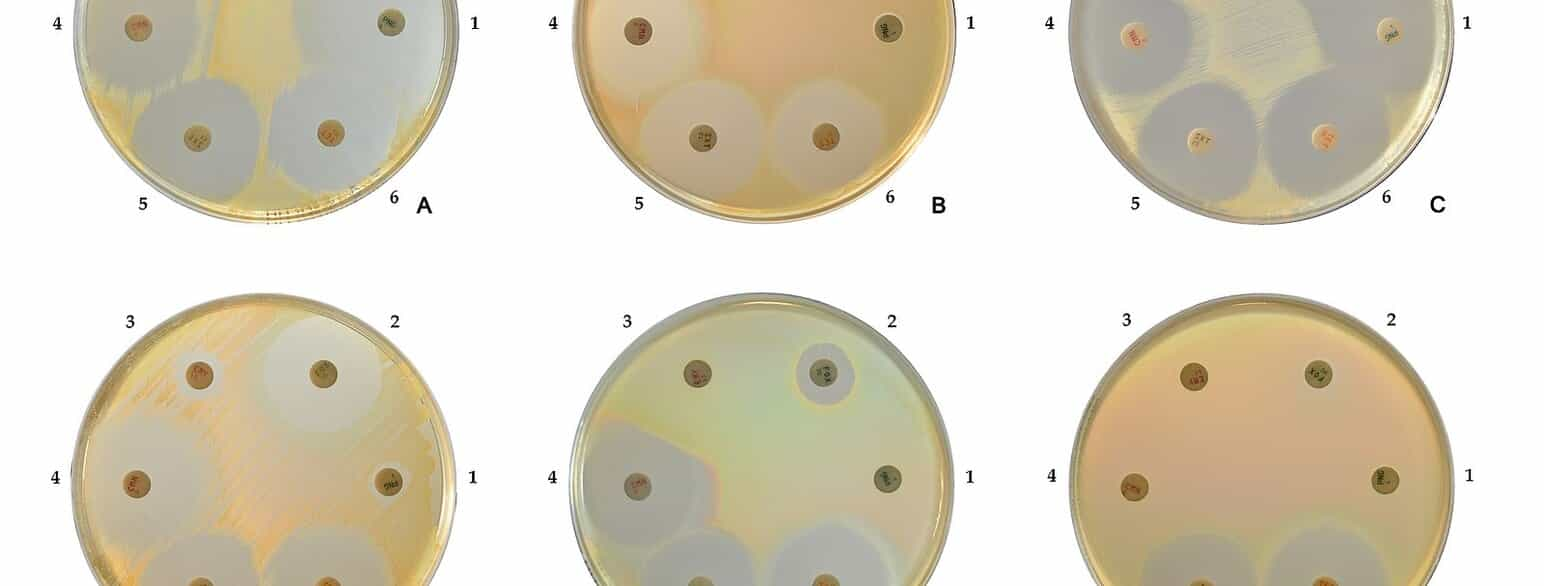
Hvis bakterien er følsom for antibiotikummet, dannes en zone uden vækst rundt om antibiotikumdepotet, som kan ses på figur 2. Denne zone kaldes hæmningszone. Hæmningszonens diameter måles, og baseret på denne bestemmes følsomhedskategorien til S, I eller R ud fra tabeller over den tidligere fastlagte sammenhæng mellem hæmningszonens diameter og bakteriens MIC overfor det pågældende antibiotikum. Metoden angiver kun en indirekte målt MIC og kræver omhyggelig standardisering. Agardiffusionsmetoden anvendes både til resistensbestemmelse af bakterier og gærsvampe.
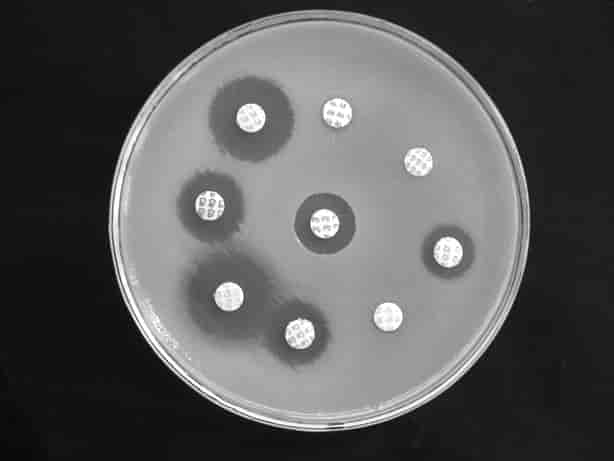
Der findes en agardiffusionsmetode, der direkte kan angive MIC. Denne metode hedder Etest® og består i en plastikstrimmel indeholdende en kontinuerlig gradient af det pågældende antibiotika som depot, og med MIC påskrevet som tal. Der dannes så, under inkubationen og fremvæksten af bakterierne, en ellipseformet (E) hæmningszone, og hvor vækstzonen rammer strimlen, aflæses den pågældende MIC (figur 3).





Kommentarer
Kommentarer til artiklen bliver synlige for alle. Undlad at skrive følsomme oplysninger, for eksempel sundhedsoplysninger. Fagansvarlig eller redaktør svarer, når de kan.
Du skal være logget ind for at kommentere.