Antibiotika er lægemidler, der bruges til behandling af infektionssygdomme, der forårsages af mikroorganismer dvs. bakterier, svampe, virus og parasitter. Oprindeligt blev antibiotika fremstillet af svampe og andre mikroorganismer ved renfremstillings- og koncentreringsprocedurer, fx blev penicillin fremstillet ud fra en skimmelsvamp. I dag kan antibiotika imidlertid syntetiseres i et laboratorie.
antibiotika
Antibiotikas historie
Den tyske læge Paul Ehrlich grundlagde i 1909 sammen med den japanske bakteriolog Sahachiro Hata (1873-1938) antibiotikaterapien med syntesen af salvarsan (arsphenamin, som de kaldte compound 606, idet de undersøgte flere hundrede nye syntetiserede kemiske arsenforbindelser).
Stoffet var effektivt til behandling af syfilis, recurrensfeber (forsaget af en Borrelia bakterie) og sovesyge (trypanosomiasis) og det blev markedsført i 1910 af det tyske firma Hoechst AG, som var en del af det tyske selskab I.G. Farben. Indtil 1932 fandtes der dog generelt ikke virksomme kemoterapeutika eller antibiotika mod bakterielle infektioner. I stedet blev der foretaget behandling med specifikke antistoffer, fx med serum fra immuniserede heste til behandling af difteritis, som Statens Serum Institut blev oprettet til at producere i 1902.
Det næste vigtige fremskridt kom i 1932, hvor kemikere fra Bayer-sektionen af I.G. Farben havde syntetiseret det første sulfonamidpræparat ud fra azofarvestoffer, som lægen Gerhard Domagk, ved hjælp af dyreforsøg viste, var effektivt over for stafylokok- og streptokokinfektioner. Den første patient blev helbredt med sulfonamid i 1933. Det var et lille barn med svær stafylokokinfektion. Sulfonamidet blev markedsført under navnet Prontosil og blev også anvendt i Danmark med gode resultater i sidste halvdel af 1930'erne. Domagk fik Nobelprisen i medicin i 1939, men Hitler nægtede ham at modtage den, så han fik den først overrakt i 1947.
Opdagelsen af penicillin
Det første antibiotikum, penicillin, blev fundet af den skotske bakteriolog Alexander Fleming. I 1928 havde han ved et tilfælde fundet et antibiotikum, som blev produceret af skimmelsvampen Penicillinum notatum, som han brugte i sit bakteriologiske arbejde i laboratoriet til selektiv rendyrkning af bakterien Haemophilus influenza. Haemophilus influenza er relativt resistent over for penicillin, mens andre bakterier som fx Staphylococcus aureus dengang var meget følsomme over for stoffet.
Det var netop hæmningen af væksten af Staphylococcus aureus omkring nogle skimmelsvampekolonier, der havde forurenet en af hans dyrkningsplader, som han så, da han vendte hjem fra sommerferie. I sin publikation fra 1929 viste han, at skimmelsvampen producerede en bakteriedræbende substans, som han kaldte penicillin.
Den første patient, der blev behandlet med oprenset penicillin, var en medicinsk patient hos Fleming på St. Mary's Hospital i London, som fik en alvorlig pneumokok-øjenbetændelse. Fleming behandlede infektionen med sin "skimmelsaft" (penicillin) og infektionen forsvandt hurtigt. Penicillin blev senere udviklet i England til terapeutisk brug af lægen Howard Florey og biokemikeren Ernst Chain, som sammen med Fleming fik Nobelprisen for deres arbejde i 1945.
De første videnskabelige arbejder, der omhandlede penicillin blev publiceret i 1940 og 1941, men på grund af 2. Verdenskrig blev det ikke umiddelbart tilgængeligt til terapeutisk brug. Der var dog et samarbejde mellem medicinalfabrikker i England og USA, hvor penicillin blev fremstillet til brug for disse landes sårede soldater med gode resultater.
Penicillin produceret i Danmark
I Danmark havde fabrikant Knud Abildgaard fra Løvens Kemiske Fabrik (nu Leo Pharma) erhvervet en kopi af Flemings 1941-artikel om penicillin fra Sverige, som han gav til professor K.A. Jensen. K.A. Jensen havde besøgt Fleming i 1929 og besluttede sig for selv at forsøge at finde en penicillinproducerende skimmelsvamp. Det lykkedes, og han og hans medarbejdere oprensede tilstrækkeligt med penicillin til at afprøve det på forsøgsdyr og siden på raske forsøgspersoner.
Herefter blev de første patienter i foråret 1943 behandlet med dansk fremstillet penicillin. Igen trådte fabrikant Abildgaard til og stillede fabrikkens ressourcer til rådighed for produktionen af penicillin. Ved slutningen af krigen var Danmark det eneste land uden for England og USA, der producerede penicillin, og produktionen kunne dække hjemmemarkedet. Alt dette skete uden, at tyskerne fik fat i det, selvom de var opmærksomme på omtalen af det nye antibiotikum, og af samme grund blev de videnskabelige artikler om emnet først skrevet og publiceret ved slutningen af eller lige efter krigen.
Løvens Kemiske Fabrik dækkede senere en stor del af verdensmarkedet for penicillin. På grund af Danmarks penicillinproduktion fik Danmark på et tidligt tidspunkt ret store rationer af det nye antibiotikum streptomycin. På opfordring af Sundhedsstyrelsen blev det K.A. Jensen, som stod for fordelingen af antibiotika og udarbejdelsen af retningslinjer for antibiotisk behandling. For at kunne styre behandlingen var det nødvendigt at stille den korrekte bakteriologiske diagnose og bestemme, om de fundne bakterier var følsomme over for de forskellige antibiotika. K.A. Jensen havde allerede i 1943 udarbejdet en agadiffusionsmetode til dette formål og yderligere udarbejdet sin egen mikrobiologiske metode til bestemmelse af koncentrationen af antibiotika i blod og vævsvæsker for derved at kunne dosere antibiotika rationelt.
Siden blev en lang række andre antibiotika opfundet, og et af de tidligste og vigtigste var dengang aminoglykosidet streptomycin, der var effektivt over for tuberkulose og infektioner forårsaget af gramnegative bakterier. Det blev fundet af den jødiske bakteriolog Selman Waksman, som kom fra Ukraine til USA og forskede i jordbakterier. Han og hans medarbejdere screenede et meget stort antal jordbakterier og fandt, at nogle actinomycet-bakterier lavede substanser, der var giftige for andre bakterier.
Han isolerede Streptomyces griseus, der er nært beslægtet med de actinomycet-arter, han havde arbejdet med, men som producerede et antibiotikum, han kaldte streptomycin i 1944. Han modtog i 1952 Nobelprisen i medicin for sin opdagelse.
I Danmark har Løvens Kemiske Fabrik siden fundet to helt nye antibiotika, fusidinsyre (Fucidin®) og mecillinam (Selexid®), som stadig er i brug i dag.
Antibiotikas virkemåde
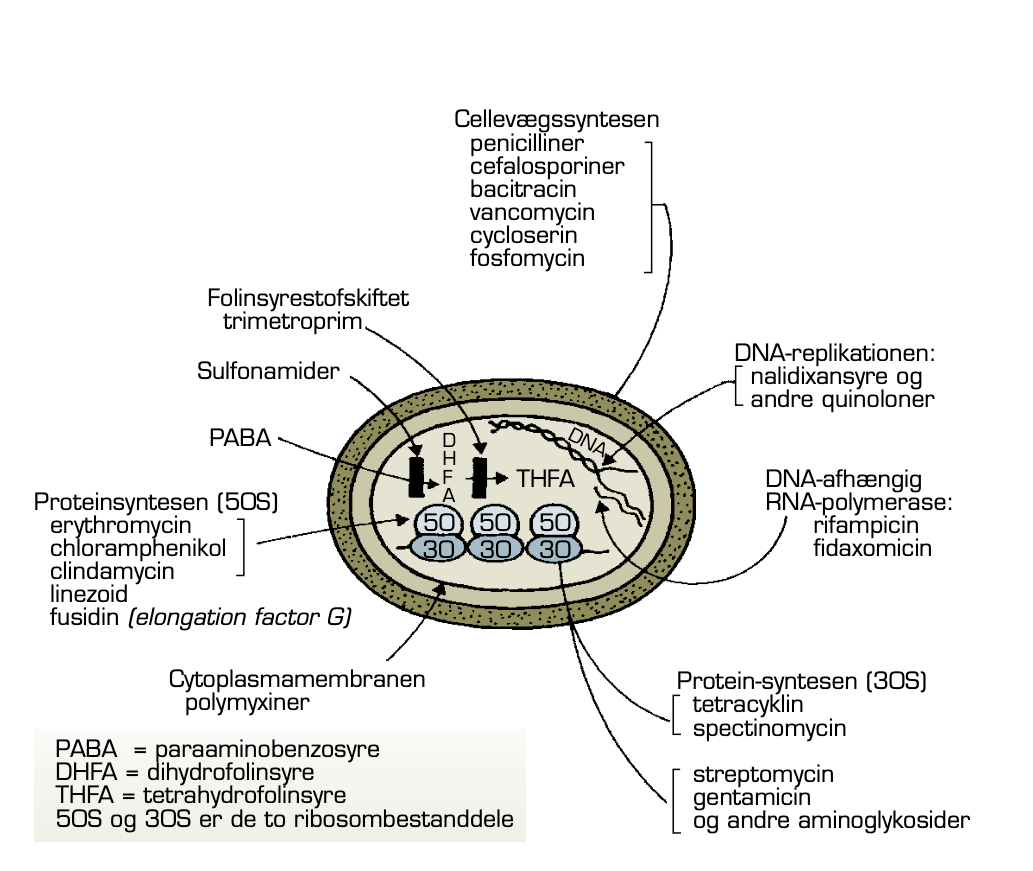
Figur 1. Oversigt over antibiotikas virkningsmekanismer.
Fra Fra N. Høiby & Å. Bengård-Andersen: Klinisk Mikrobiologi og Infektionsmedicin. FADLs Forlag, 2021.
Antibiotika adskiller sig fra desinfektionsmidler ved at være ugiftige for patienterne, men giftige for mikroorganismerne, såkaldt selektiv toksicitet. Den selektive toksicitet kan være meget udpræget, så bivirkninger, bortset fra allergiske, kun ses ved doseringer på måske ≥100 gange normaldoseringen, for fx penicillin. I så fald siges stoffet at have et højt terapeutisk index, hvilket betyder, at der er høj ratio mellem toksisk dosis og terapeutisk dosis.
For nogle antibiotikas vedkommende, fx aminoglykosider, er denne ratio til gengæld lille. Her vil en fordobling af dosis give toksiske bivirkninger hos nogle patienter, og det har derfor et lavt terapeutisk index. I disse tilfælde overvåges antibiotikakoncentrationen i patientens blod, så den ikke bliver for høj.
Den selektive toksicitet skyldes, at antibiotika virker på stofskifteprocesser og -strukturer i mikroorganismerne, som enten ikke findes hos mennesker, eller som adskiller sig på afgørende punkter fra tilsvarende processer og strukturer hos mennesker. Når stofferne skal virke på bakteriecellen, skal nogle af dem passere både cellevæggen og cytoplasmamembranen. Den grampositive cellevæg med kapsel og peptidoglykanlag udgør ikke nogen større barriere for antibiotikummet, og grampositive bakterier er derfor som regel følsomme over for flere typer antibiotika end gramnegative bakterier.
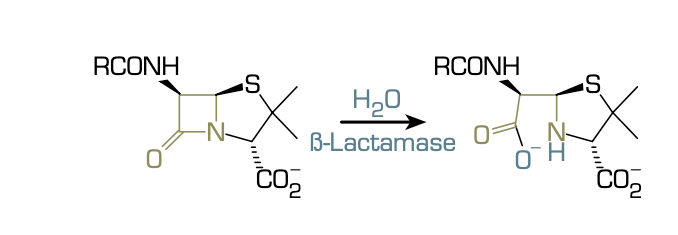
Mykobakterier og gramnegative bakteriers cellevægge udgør derimod barrierer for mange typer antibiotika, fx beta-laktamantibiotika, der dækker over penicilliner, cefalosporiner, carbapenemer og monobactamer. Det er årsagen til antibiotikas forskellige spektre. Nogle antibiotika er virksomme over for mange forskellige bakterier, både grampositive og gramnegative, og kaldes derfor bredspektrede, fx tetracyklin. Andre er kun virksomme over for få bakterier, fx enten grampositive eller gramnegative, og kaldes derfor smalspektrede.
Ved mindre ændringer af antibiotikamolekylerne, fx ved kobling af en ny sidekæde til antibiotikamolekylet, kan antibiotikummets spektrum ændres. Fx virker almindeligt benzylpenicillin næsten udelukkende på grampositive bakterier, mens mecillinam, der er et penicillin med en anden sidekæde, næsten kun virker på gramnegative bakterier. Ligeledes er piperacillin, der er et penicillin, virksomt mod både grampositive og gramnegative bakterier.
Effekten af disse penicilliner er den samme: de hæmmer nogle enzymer (transpeptidaser), der er med til at producere cellevæggen hos både grampositive og gramnegative bakterier. Det ligeledes bredspektrede penicillin-lignende imipenem, der er et carbapenem, virker også på mykobakterier med den syrefaste cellevæg og derudover på både grampositive og gramnegative bakterier.
Antibiotika kan enten hæmme væksten af bakterier (bakteriostatisk), eller de kan dræbe dem (bakteriocidt). Antibiotika angriber bakterien på forskellige måder (figur 1).
Inddeling i grupper
Efter virkemåde og kemisk struktur inddeles antibiotika i grupper med mere eller mindre nært beslægtet struktur og virkemåde, med eksempler:
- Beta-laktamantibiotika, der har en speciel ringstruktur i sit molekyle, beta-laktam-ringen: penicilliner, cefalosporiner, monobaktamer, carbapenemer.
- Aminoglykosider: gentamicin og tobramycin.
- Tetracykliner: oxytetracyklin, tetracyklin, doxycyklin.
- Makrolider: erytromycin, clarithromycin, azithromycin.
- Andre antibiotika: kloramfenikol, vancomycin, clindamycin, fusidin, metronidazol, rifampicin, ciprofloxacin, linezolid, telitromycin, tigecyklin, polymyxin, daptomycin, sulfonamider, trimetoprim, fosfomycin og andre.
Udvikling af antibiotikaresistens
Resistens er, når bakterier og andre mikroorganismer bliver modstandsdygtige over for fx antibiotika. De enkelte bakteriers naturlige følsomhed over for antibiotika varierer, og denne naturlige følsomhed kan ændres. Resistens kan skyldes nedbrydende enzymer, som ødelægger antibiotika.
Resistens kan også skyldes, at målet for antibiotikummet muterer, så bindingsstyrken nedsættes, og bakterien bliver resistent. Fx kan transpeptidaserne i bakterien muterer under cellevægsdannelsen, hvilket medfører, at bindingsstyrken af beta-laktamantibiotika nedsættes, og bakterien bliver resistent over for nogle beta-laktamantibiotika. Det gælder således for methicillin-resistente Staphylococcus aureus (MRSA).
Overførsel af antibiotikaresistens
Antibiotikaresistens kan overføres mellem bakterier ved hjælp af enten vertikal eller horisontal genoverførsel.
Vertikal genoverførsel
Resistens kan opstå ved mutationer hos bakterien og ved overførsel af genetisk materiale, som koder for resistens til bakterien. Kromosomale, vækstbetingede mutationer opstår spontant med en hyppighed på 1 per 107- 1012 bakterier i en regensglaskultur, men da antallet af bakterier i fx afføring er ca. 1011 per gram, sker resistensudvikling ved mutationer hele tiden.
Yderligere øges mutationshyppigheden hos bakterier under indflydelse af antibiotika pga. påvirkningen af bakteriernes stofskifte, der frembringer reaktive iltradikaler (ROS), som bidrager til bakteriedrabet. Men hvis bakterierne ikke dør, medfører ROS mange mutationer, som frembringer resistens over for flere antibiotika. Disse resistente mutanter selekteres så under fortsat antibiotikabehandling. Det kaldes vertikal genoverførsel, der er det samme som mor-til-barn overførsel af genetiske egenskaber. Bakterierne overfører altså arvematerialet til deres afkom.
Horisontal genoverførsel
Resistensgener kan også overføres fra én resistent bakterieart til andre bakterier, beslægtede og ubeslægtede, på følgende måder:
- plasmider, der overføres mellem bakterier ved konjugation, hvor bakterierne hænger sammen
- transduktion med bakteriofager
- transformation, hvor ekstracellulært DNA frigjort fra den resistente bakterie optages af andre bakterier.
De tre metoder kaldes horisontal genoverførsel og de resistente bakterier kaldes for rekombinanter. Selektion ved brug af antibiotika giver så de resistente bakterier en selektiv fordel, da de følsomme bakterier dræbes. Stort forbrug af antibiotika både til mennesker, landbrugsdyr og fiskeopdræt fører derfor til generel stigning af resistente bakterier. Risikoen for resistensudvikling er størst i vores og dyrs normalflora på slimhinder og hud, hvorfra resistensgener så kan overføres til infektionsfremkaldende bakterier.
Valg af antibiotikum
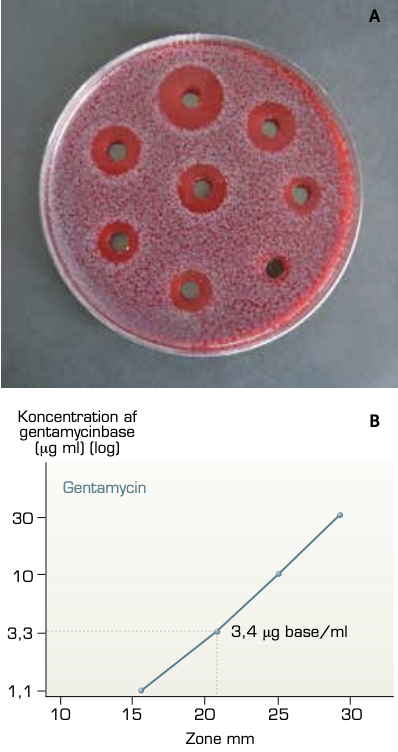
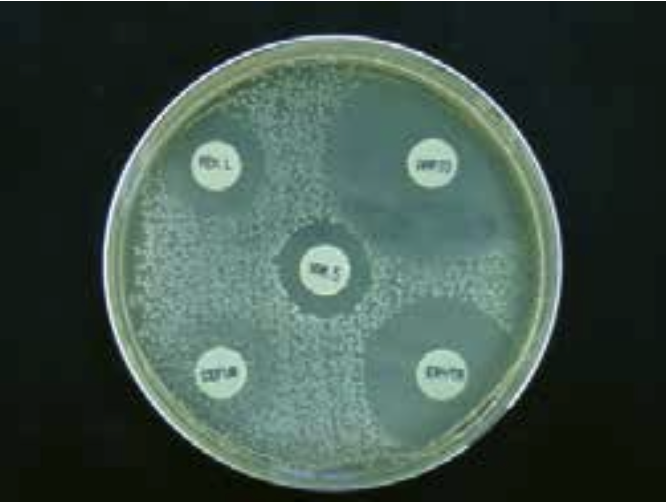
Ofte vil den behandlende læge have kendskab til, hvilket antibiotikum en bestemt sygdom bedst behandles med. I tvivlstilfælde kan der foretages en resistensundersøgelse. Undersøgelsen udføres på en vækstplade i et laboratorie med bakterieholdigt materiale fra patienten, fx urin, sammen med små tabletter indeholdende forskellige antibiotika. Bakteriernes vækst vil i større eller mindre omfang blive hæmmet omkring disse tabletter. Ses der ingen bakteriefri zone omkring en antibiotikatablet, betegnes bakterien som resistent over for det pågældende antibiotikum. Jo mere følsom bakterien er over for midlet, jo større vil den bakteriefri zone omkring antibiotikatabletten være. Behandling med antibiotika kan medføre allergiske reaktioner. Dette får betydning for valg af antibiotikum, hvis det er kendt, at patienten fx har penicillinallergi.
Læs mere på lex.dk
- penicillin
- resistens
- multiresistente bakterier
- MRSA
- hospitalsinfektion




Kommentarer
Kommentarer til artiklen bliver synlige for alle. Undlad at skrive følsomme oplysninger, for eksempel sundhedsoplysninger. Fagansvarlig eller redaktør svarer, når de kan.
Du skal være logget ind for at kommentere.