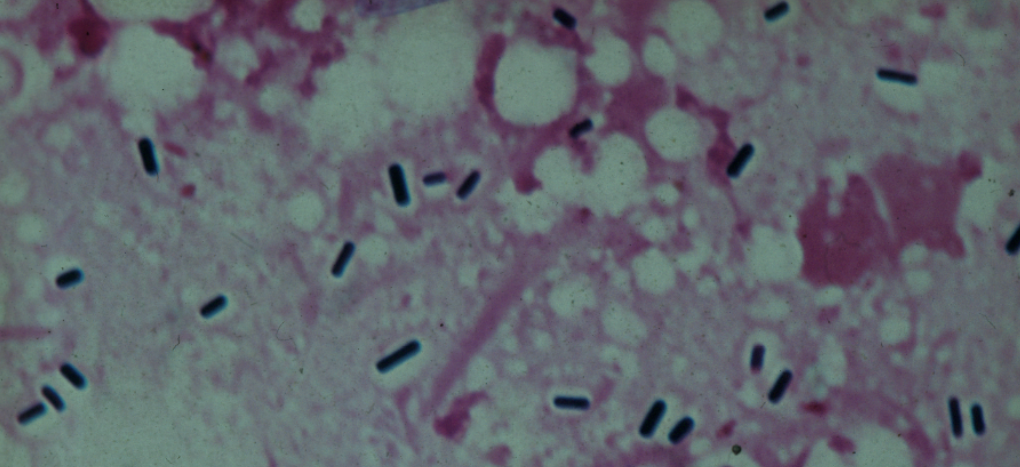
Clostridium er en slægt af grampositive, stavformede bakterier, der har størrelsen 0,4-1,2 × 3-8 μm. De tåler ikke ilt (anaerobe) og danner endosporer. De fleste er bevægelige ved hjælp af svingtråde (flageller). Der findes over 240 arter, som er udbredt i naturen i jord, vand og i affald. Endvidere findes visse arter som normalflora i dyrs og menneskers tarm. Kun få af arterne er sygdomsfremkaldende hos mennesker.
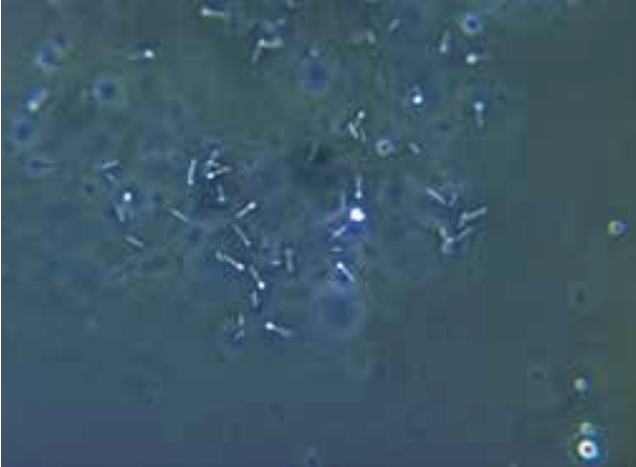
En fremtrædende egenskab hos Clostridium er deres evne til at omdanne (fermentere) organisk materiale, fx kulhydrater, og nedbryde proteiner til bl.a. alkoholer, organiske syrer og luft (gas), som er ildelugtende. Nogle klinisk vigtige arter kan danne giftstoffer (eksotoksiner). Under stress, fx ved manglende næringsstoffer, danner Clostridium sporer inde i bakterien (endosporer). Diameteren af endosporerne er ofte større end bakteriecellens diameter, hvilket giver bakterien et karakteristisk opsvulmet udseende (Figur 1). Sporerne er meget resistente over for fysiske og kemiske påvirkninger og tåler udtørring og kogning, men ikke autoklavering. Sporerne kan derfor overleve længe efter, at den omgivende bakterie er gået til grunde.




Kommentarer
Kommentarer til artiklen bliver synlige for alle. Undlad at skrive følsomme oplysninger, for eksempel sundhedsoplysninger. Fagansvarlig eller redaktør svarer, når de kan.
Du skal være logget ind for at kommentere.