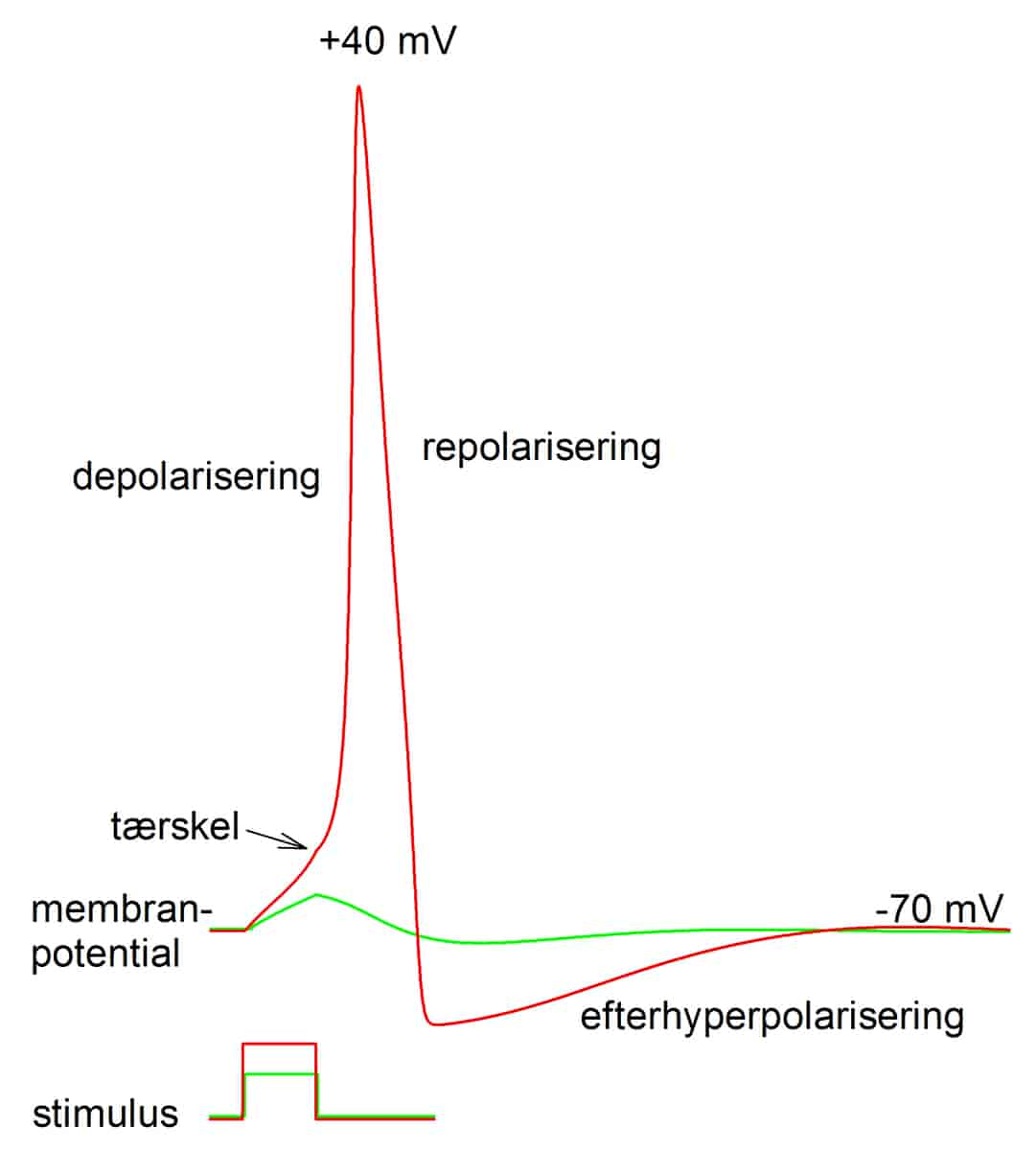
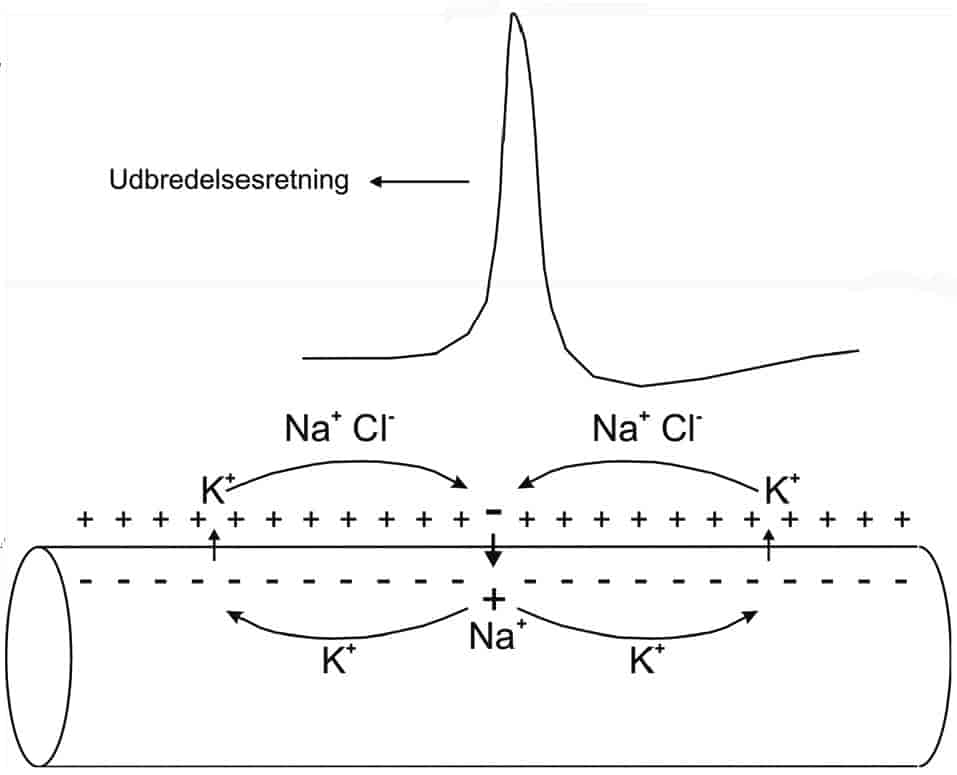
Ionstrømmene, der genererer aktionspotentialet, løber ikke kun ind og ud gennem membranen, men også langs membranen på indersiden og ydersiden, som det ses på figur 3.
Strømmen af positive natriumioner løber ind og gør axonets initialsegment mere positivt indvendigt under depolariseringsfasen. Herved opstår der en potentialforskel mellem initialsegmentets indre og den del af axonet, som ligger længere væk fra cellelegemet. Det medfører, at der opstår en længegående elektrisk strøm fra initialsegmentet og videre ud i axonets indre. Denne strøm vil gradvist depolarisere axonet foran det sted, hvor aktionspotentialet er, og når denne depolarisering er stor nok, dannes der også et aktionspotential længere ude i axonet. Aktionspotentialet har altså flyttet sig et stykke ud ad axonet ved hjælp af en længdegående strøm inde i axonet. Processen gentager sig, indtil aktionspotentialet har nået enden af axonet.
Elektrisk strøm kan kun løbe i lukkede kredsløb, og i figur 3 illustreres det, hvorledes den samlede strøm gennem membranen, hvor aktionspotentialet er, og i naboregionerne, hvor aktionspotentialet har været, og hvortil det snart ankommer, ser ud. Strømmen bæres af de ioner, der er til stede i det ledende medie, som er væsken inde i axonet og væsken udenfor – svarende til K+ inde i axonet og Na+ og Cl- udenfor.
Længden af den forreste strømsløjfe bestemmer axonets ledningshastighed. Hvis axonet er tykt, løber strømmen inde i axonet med mindre modstand, og den bliver derfor længere. Det er forklaringen på, at tykke axoner leder hurtigere end tynde.
Hvis axonmembranen ikke tillader den indre strøm at løbe ud, så bliver strømsløjfen også længere. Nogle axoner er pakket ind i fedtstoffet myelin, og det gør membranen meget tæt, så disse myeliniserede axoner har også høj ledningshastighed. Myelinen sidder ikke overalt. Med mellemrum er der små ophold i myelinbeklædningen, som kaldes ranviers'ke indsnøringer, hvor membranen er nøgen, og her kan der dannes aktionspotentialer. I myeliniserede axoner springer eller hopper aktionspotentialet fra indsnøring til indsnøring. Det kaldes saltatorisk ledning.
De hurtigste axoner hos både motorneuroner og sensoriske neuroner er tykke og myeliniserede. Myelin beklæder også mange axoner inde i hjerne og rygmarv, og det er denne myelin, der ødelægges ved sygdommen multipel sklerose.






Kommentarer
Kommentarer til artiklen bliver synlige for alle. Undlad at skrive følsomme oplysninger, for eksempel sundhedsoplysninger. Fagansvarlig eller redaktør svarer, når de kan.
Du skal være logget ind for at kommentere.